Curso Online
4 de Octubre 2023
Aplicación de AQbD y de la estrategia de ciclo de vida
Contenido del curso
La validación de los métodos analíticos para controlar productos farmacéuticos (ICH Q2) se suelen tratar como un evento que se realiza una única vez, sin incorporar el concepto de monitorización de la fiabilidad y consistencia del método a lo largo del tiempo.
La aplicación de los criterios para el desarrollo farmacéutico de ICH Q8 (Pharmaceutical Development), y por consiguiente el concepto de diseñar la calidad (QbD – Quality by Design), se van aplicando cada día más en las etapas de desarrollo y fabricación de medicamentos y esta misma estrategia se aplica también al proceso de diseño, transferencia y validación de métodos analíticos (ICH Q14 – Analytical procedure development).
Objetivos del curso
Conoceremos como aplicar los principios de QbD en el ciclo de vida de los métodos analíticos, para ser capaces de diseñar un proceso robusto, identificando sus fuentes de variabilidad, y diseñando una estrategia de trabajo que permita mantenerlas bajo control.
Quién debe asistir
Este Curso de Formación Especializada está dirigido a directores, gerentes, responsables y técnicos que desarrollen actividades en el área industrial (Producción, Laboratorio de Control, Regulatory Affairs, Garantía de Calidad, Validaciones, Tecnología, Ingeniería, etc.) y en las Áreas de I+D+I y Desarrollo Farmacéutico y Galénico.
PROFESOR: David Martínez.
Analytical Development Manager en LABORATORIOS ALTER. Licenciado en Ciencias Químicas (Universidad San Pablo CEU) y Máster en Tecnología y Gestión de la industria Química (Centro de Estudios Superiores de la Industria Farmacéutica-CESIF).
Profesional con más de 18 años de experiencia en el sector farmacéutico. Inició su carrera en el departamento de Control de Calidad de multinacionales farmacéuticas pasando posteriormente al departamento de I+D de Laboratorios Alter donde desarrolló funciones en las áreas de estabilidades, así como desarrollo, validación y transferencia de métodos analíticos. Siendo actualmente el responsable del departamento de Desarrollo Analítico.
PROFESORA: Pilar Pérez Lozano.
Profesora Titular de la Facultad de Farmacia y Ciencias de la Alimentación en UNIVERSIDAD DE BARCELONA.
Doctora en Farmacia por la Universidad de Barcelona (2002). Máster en Docencia Universitaria (UB), 2004 Máster en cromatografía líquida (IUCT), 2001. Curso de postgrado de experto en aplicación práctica de la estadística en los procesos de la industria farmacéutica y afines (UB), 2021.
Actualmente, profesora Titular de Tecnología Farmacéutica Industrial (Área Farmacia y Tecnología Farmacéutica) de la Facultad de Farmacia y Ciencias de la Alimentación de la Universidad de Barcelona y Responsable de Control de Calidad y Garantía de Calidad de proyectos del Servei de Desenvolupament del Medicament (planta piloto de la Facultad de Farmacia y Ciencias de la Alimentación).
Programa del curso Validación de métodos analíticos
PARTE 1:
Introducción
- Regulación aplicable a la validación de métodos analíticos
- Ciclo de vida de un método analítico
- ICH Q14
- ICH Q2(R2)
Etapas del desarrollo de un método analítico según ICH Q14
- Etapa 1: Diseño de procedimiento
- Establecimiento ATP (Perfil analítico objetivo)
- Selección técnica analítica en base ATP
Pausa descanso
PARTE 2:
Etapas del desarrollo de un método analítico según ICH Q14
- Etapa 1: Diseño de procedimiento (continuación):
- Definir parámetros críticos del método
- Desarrollo del método analítico mediante DOE
- Estrategia de control
- Caso práctico
- Etapa 2. Validación métodos
- Introducción y conceptos básicos
- Novedades guideline ICH Q2 (R2 vs R1)
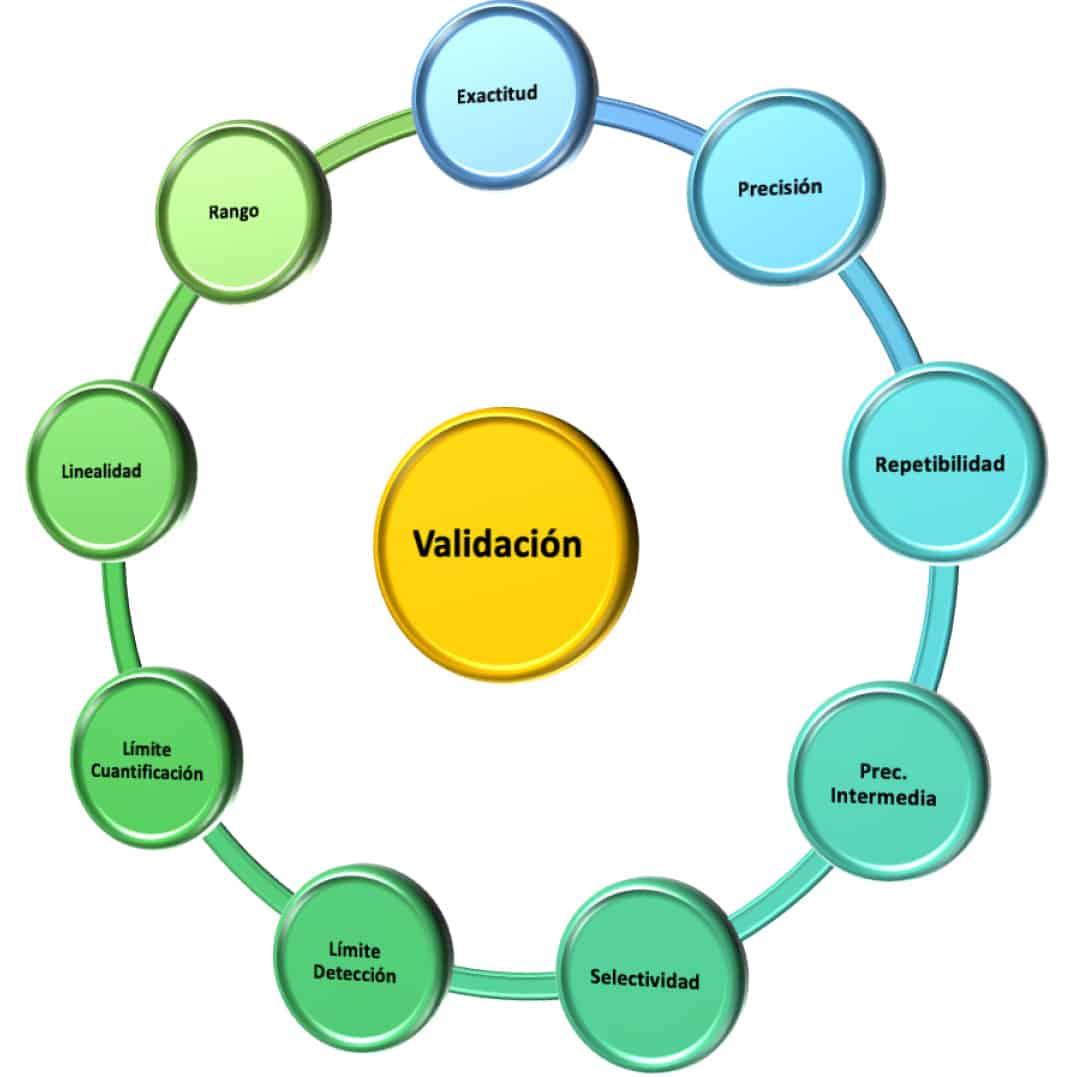
- Características de validación (selectividad, precisión, exactitud, etc.) y criterios de aceptación
Pausa descanso
PARTE 3:
Etapas del desarrollo de un método analítico según ICH Q14
- Etapa 2. Validación métodos (continuación)
- Documentación
- Caso práctico
- Etapa. 3. Transferencia y mejora continua
- Transferencia analítica
- Aplicación y criterios de aceptación
- Monitorización continua de funcionamiento del método
- Analytical Control Strategy
- Gráficas de control
Resumen de la jornada y conclusiones